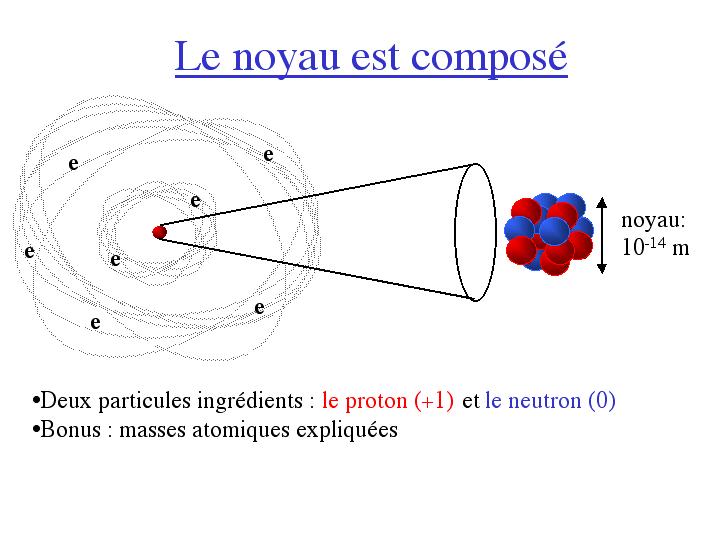
Le noyau lui-même n'est pas élémentaire: il est composé de
deux sous-constituants, le proton et le neutron. Le proton possède une
charge électrique +1, opposée à celle de l'électron;
le neutron est ... neutre (charge nulle). Ainsi, un noyau de numéro
atomique Z comporte Z protons et un nombre N de neutrons.
Cette structure nucléaire explique les masses des atomes qui sont
données dans le tableau de Mendeleiev. Effectivement, proton et neutron
ont pratiquement même masse, que l'on choisit comme masse unité.
Ils ont donc masse 1 (unité atomique). L'électron a une masse
négligeable, environ 2000 fois plus petite. La masse Mz d'un
atome vaut donc Mz = Z+N, ce qui se rapproche des masses du tableau.
Exemples:
- Hydrogène: Z=1, N=0: Mz~1
- Lithium: Z=3, N=4: Mz~7
- Oxygène: Z=8, N=8: Mz~16
Cela explique également l'existence de masses très proches pour
le Cobalt et le Nickel. En effet, le cobalt a numéro atomique Z=27 et
N=32 alors que le nickel lui a Z=28 et N=31. Tous deux ont donc une masse
avoisinant 59 unités atomiques.
On peut même comprendre le fait que les masses des atomes ne soient pas
exactement entières en unité atomique. En effet, ce qui
caractérise chimiquement l'atome, c'est le numéro atomique Z. Il
existe dans la nature des atomes ayant le même nombre atomique Z
mais des nombres de neutrons N différents: on les appelle des
isotopes.
Considérons un élément ayant deux isotopes avec des
nombres de neutrons N et N'. Dans la nature, on les trouve en proportions 1-x
et x respectivement. La masse de l'élément correspondant qui en
découle est donc une moyenne des masses des deux isotopes,
pondérée par leurs proportions respectives:
En conclusion, la connaissance de la structure interne de l'atome, avec les trois sous-constituants que sont l'électron, le proton et le neutron, permet d'expliquer le tableau de Mendeleiev.