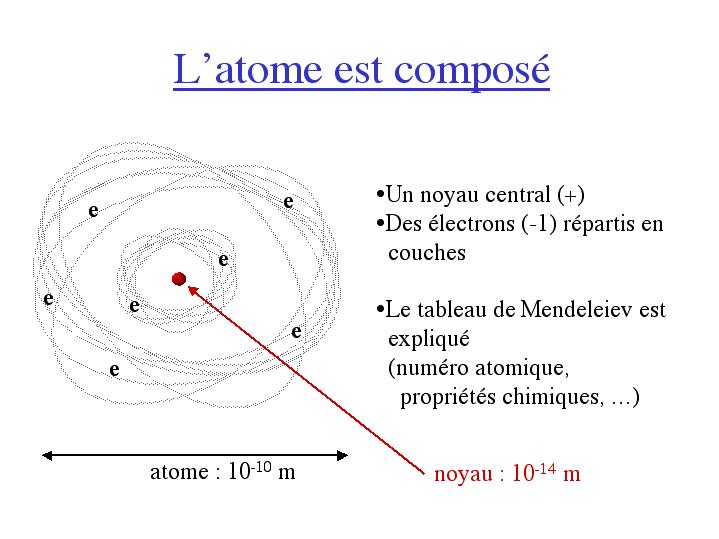
Conjointement, théorie et expérience ont permis d'affiner notre
représentation de l'atome. Il est composé:
- d'un noyau central, chargé positivement (charge +Z) de taille
10-14m, contre 10-10m pour l'atome entier
(comme une bille au milieu d'un terrain de football!).
- de Z électrons en mouvement répartis en couches, de charge
électrique -1 (ce qui compense la charge du noyau et rend l'atome
électriquement neutre).
Z vaut 1 pour l'hydrogène, 2 pour l'hélium, 6 pour le carbone,
8 pour l'oxygène, etc...
Le tableau de Mendeliev se trouve en grande partie expliqué par cette
structure atomique:
- l'ordre de classement d'un élément dans le tableau est le
numéro atomique Z.
- les propriétés chimiques des éléments proviennent
de leur structure électronique.
En effet, les atomes s'associent de manière à remplir leur couche
électronique externe:
* Exemple 1: un gaz rare comme l'hélium (He) a déjà sa
couche externe remplie et ne s'associe donc pas aux autres atomes; il est
chimiquement inerte.
* Exemple 2: l'oxygène (O) et le soufre (S), dans la même colonne,
ont chacun besoin de deux électrons pour saturer leur couche externe.
Ils les trouvent en se combinant par exemple à deux atomes
d'hydrogène (H, qui possède un électron) pour former
respectivement les molécules d'eau (H2O) et de sulfure
d'hydrogène (H2S).
- la régularité du tableau (lignes de 2, 8, 18... éléments) est expliquée par le nombre correspondant d'électrons que peut accueillir une couche.